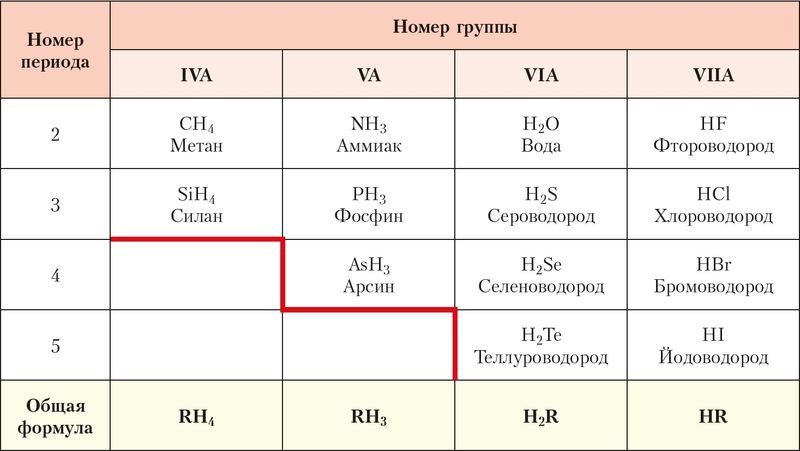
Какую реакцию среды имеют водные растворы солей железа 3 почему
Аналитическая химия
Главная страница Статьи. Определение: Гидролиз солей — это взаимодействие ионов соли с водой с образованием малодиссоциирующих частиц. Гидролиз, дословно, - это разложение водой.

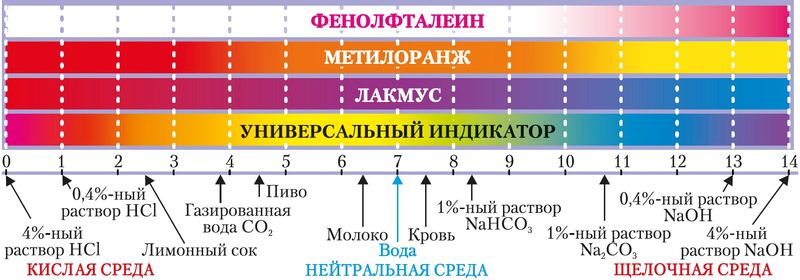





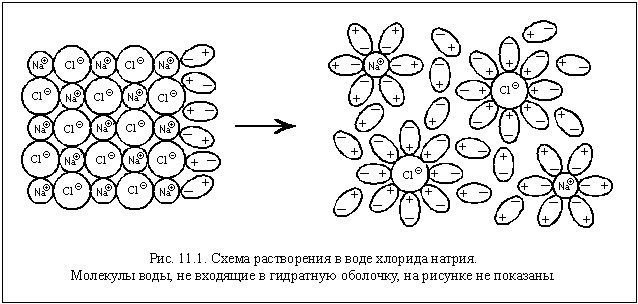
Для того, чтобы понять, что такое гидролиз солей, вспомним для начала, как диссоциируют кислоты и щелочи. На первый взгляд, она всегда должна быть нейтральной. И правда же, откуда, например, в растворе сульфида натрия взяться избытку катионов водорода или гидроксид-ионов. Сам сульфид натрия при диссоциации не образует ионов ни одного, ни другого типа:. Тем не менее, если бы перед вами оказались, к примеру, водные растворы сульфида натрия, хлорида натрия, нитрата цинка и электронный pH-метр цифровой прибор для определения кислотности среды вы бы обнаружили необычное явление.







В году немецким химиком Леопольдом Гмелином соединение было приготовлено путём окисления «жёлтой кровяной соли». Этот факт, а также красный цвет кристаллов, обусловили происхождение традиционного названия «красная кровяная соль». Водный раствор зеленовато-жёлтого цвета. В этаноле нерастворим. Гексацианоферрат III калия — очень сильный окислитель, особенно в щелочной среде.